ニュース
NEWS
【がん幹細胞を標的とする新規治療薬の開発に大きく貢献】
SIGMAR1遺伝子が肺がん幹細胞の潜在的マーカーであることを同定。金沢工業大学 大学院バイオ・化学専攻博士前期課程2年の桑野彩音さんと 金沢医科大学との研究チーム
金沢工業大学大学院バイオ・化学専攻博士前期課程2年の桑野彩音さんと金沢医科大学の研究チームが、SIGMAR1※遺伝子が肺がん幹細胞の潜在的マーカーであることを同定しました。がん幹細胞を標的とする新規治療薬の開発に大きく貢献するものと期待されています。
当研究成果は、シュプリンガーネイチャーが出版する、がんに対するあらゆる側面に関する研究を扱う査読付き国際学術雑誌『Discover Oncology』(Published: 26 April 2025)に掲載されました。
【論文タイトル】
In silico-based analysis and in vitro experiments identify SIGMAR1 as a potential marker of putative lung cancer stem cells
(日本語訳:In silico※ベースの解析とin vitro※実験により、SIGMAR1が肺がん幹細胞の潜在的マーカーであることが同定された)
【掲載誌】
『Discover Oncology』 Published: 26 April 2025
https://doi.org/10.1007/s12672-025-02394-6
【著者】
Tetsuhiro Horie(1), Ayane Kuwano(2), Takuya Sakamoto(3), Yuka Nakamura(4), Kayoko Yamaguchi(5), Ikuhiro Tanida(6), Satoshi Osawa(7), Kazuo Yasumoto(8) & Yasuhito Ishigaki(9)
(1) 堀江 哲寛 金沢医科大学 総合医学研究所 助教、 (2) 桑野 彩音 金沢工業大学工学研究科 バイオ・化学専攻博士前期課程2年、 (3) 坂本 卓弥 金沢医科大学 総合医学研究所 助教、(4) 中村 有香 金沢医科大学 総合医学研究所 助手、(5) 山口 加代子 金沢医科大学 総合医学研究所 リサーチアドミニストレーター 、(6) 谷田 育宏 金沢工業大学 バイオ・化学部 環境・応用化学科 准教授、(7) 大澤 敏 金沢工業大学 バイオ・化学部 環境・応用化学科 教授、(8) 安本 和生 金沢医科大学 医学部 教授、(9) 石垣 靖人 金沢医科大学 総合医学研究所 教授
当研究の概略
【研究の背景】
肺がんは世界で最も患者数が多いがんであり、様々な薬剤が開発されているにもかかわらず、予後(病気や手術などについて、その後の経過の見通し)は依然として不良です。その理由として、手術を受けた肺がん患者の多くは数年以内に再発を経験し、骨、脳、肝臓などの他の臓器への転移も頻繁に観察されるなど、再発と転移の割合が高いことが挙げられます。
がん幹細胞(Cancer stem cell)理論は、がんの再発、転移、治療抵抗性など、その根本原因を説明するために提唱されている理論です。がん幹細胞は、白血病、骨肉腫、膠芽腫などの多くのがんに存在し、自己複製や分化を通じてがん細胞を継続的に供給する能力を有しています。肺がん組織中にも肺がん幹細胞が存在し、肺がん幹細胞の機能を制御する遺伝子がこれまでにいくつか報告されています。
多くの研究から、(一般的な)がん細胞と比較して、がん幹細胞は静止状態に維持されていること、抗がん剤を細胞外に排出する能力が増強されていることなどが明らかとなっており、これらの特徴が原因で既存の薬物治療や放射線治療が効きにくいことが指摘されています。したがって、治療によってがん細胞が除去され、腫瘍が一時的に退縮しても、生き残ったがん幹細胞が再びがん細胞を供給するため、腫瘍は再発/転移すると予想されます(図1)。
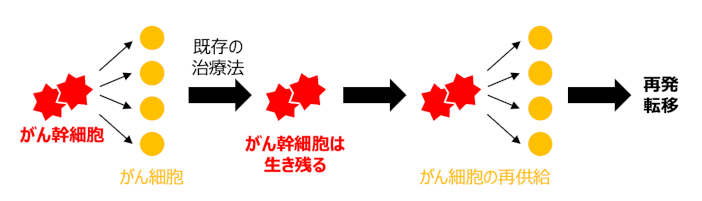
がんの完治という観点からは、がん幹細胞を除去することが重要ですが、がん幹細胞の機能が維持されるメカニズムはよくわかっていないため、がん幹細胞の生物学的特性を解明することで、がん幹細胞を標的とする新規治療薬の開発に大きく貢献することが期待されています。
そこで研究チームでは、東京大学医科学研究所ヒトゲノム解析センターのスーパーコンピュータを用いたin silico解析によって肺がん幹細胞の新規マーカーを同定し、培養細胞を用いたin vitro実験でその発現と機能を検証しました(図2)。

【方法】
研究チームは、がん幹細胞で発現が上昇している遺伝子を同定するために、オンラインで公開されているヒト肺がん組織のscRNA-seq※データセットを再解析しました。続いて、代表的な肺がん細胞株であるA549細胞由来の腫瘍球を肺がん幹細胞のモデルとして用い、in silico解析で同定した候補遺伝子の肺がん幹細胞における役割を調べました。
【結果】
In silico解析の結果から、肺がん幹細胞ではSIGMAR1遺伝子の発現が顕著に上昇していることが明らかとなりました。また、肺がん幹細胞から肺がん細胞に変化(分化)するのに伴ってSIGMAR1遺伝子の発現が低下することがわかりました。続いてin vitro解析から、肺がん幹細胞でSIGMAR1の発現が実際に上昇していることを確認しました。さらに、siRNA※を用いてSIGMAR1遺伝子をノックダウン※することで、肺がん幹細胞の機能制御に重要な遺伝子の発現が抑制され、さらに腫瘍球のサイズが小さくなる(=治療効果が認められる)ことが示されました(図3)。
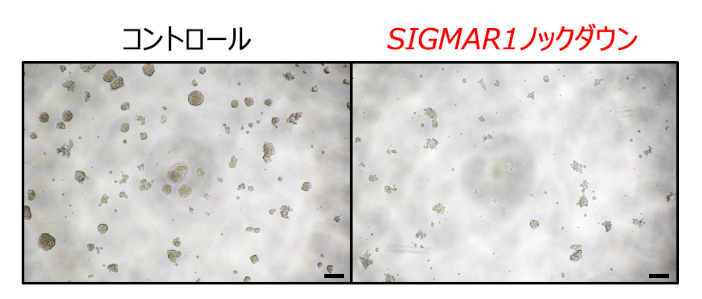
【結論】
In silicoとin vitroの実験から、SIGMAR1はヒト肺がん幹細胞で高発現しており、がん幹細胞の機能調節に重要な役割を果たしていることが示唆されました。SIGMAR1の機能を阻害する化合物は既に複数開発されており、これらが肺がん幹細胞を標的とした新規抗がん剤となることが期待されます。今後は、SIGMAR1ががん幹細胞の特性を調節する根本的なメカニズムを解明していく予定です。
【謝辞】
本研究は日本学術振興会科学研究費助成事業(JP22K20726、JP22K19390)、第38回北國がん基金研究活動助成の支援を受けて実施されました。
※SIGMAR1:Sigma non-opioid intracellular receptor 1。全身の細胞に発現しており、様々な細胞機能の制御に関与していることが示唆されている。
※In silico:生命科学や薬学などの分野でコンピュータを用いたシミュレーションや解析を指す言葉。
※in vitro:語源は「試験管内で」を意味するラテン語で、主に培養細胞を用いた実験を指す言葉。
※scRNA-seq:シングルセルRNAシークエンス。1細胞ごとに遺伝子の発現量を網羅的に調べることができる。
※siRNA:Small interfering RNAの略。タンパク質の設計図であるmRNAを分解させることで、特定の(今回はSIGMAR1)タンパク質の産生を抑制できる。
※ノックダウン:特定の遺伝子の発現・機能を抑制させること。
(関連ページ)
